Росздравнадзор, осуществляющий контроль за деятельностью в сфере здравоохранения и медицинского обеспечения, внес радикальные изменения в правила оборота лекарственных средств в России. Новые нормативно-правовые акты направлены на обеспечение безопасности и эффективности применения лекарственных препаратов, а также на соблюдение производственных и хранительных условий.
Одно из ключевых изменений – введение обязательной сертификации всех лекарственных средств перед их ввозом и производством на территории России. Сертификация будет проводиться специализированными аккредитованными органами, которые проверят соответствие препарата требованиям стандартов качества и эффективности.
Кроме того, Росздравнадзор внедряет новые системы контроля качества и подлинности лекарственных средств. В рамках новых правил каждое лекарство будет иметь уникальный идентификационный код, что позволит отслеживать его перемещение на всех этапах жизненного цикла – от производства до потребителя. Это поможет исключить фальсификацию и контрафакцию медикаментов, что является актуальной проблемой в наше время.
В целях обеспечения бесперебойного поставок лекарственных средств, Росздравнадзор также ставит перед производителями и поставщиками требования в отношении мониторинга качества и сроков годности продукции. Теперь каждая партия лекарства должна быть оценена на соответствие его характеристикам и надлежащим производственным условиям. Это позволит избежать появления просроченных и некачественных препаратов на рынке и защитит здоровье граждан.
Росздравнадзор регулирует
Один из важных аспектов регулирования, осуществляемого Росздравнадзором, — это лицензирование деятельности по производству, хранению и реализации лекарственных средств. Для получения лицензии необходимо соответствовать определенным требованиям, включая наличие квалифицированного персонала, соответствующего оборудования и применение соответствующих технологий.
Кроме того, Росздравнадзор проводит проверки предприятий, осуществляющих деятельность в сфере производства и продажи лекарственных средств, с целью выявления нарушений и предотвращения рисков для здоровья населения. В случае обнаружения нарушений, Росздравнадзор вправе применять меры административного или другого вида ответственности.
Одной из новых мер, введенных Росздравнадзором, является обязательная регистрация лекарственных средств перед их выпуском на рынок. Это позволяет контролировать состав и качество препаратов, исключая подделку и недобросовестную деятельность.
Регулирование оборота лекарственных средств Росздравнадзором является важной составляющей мер по обеспечению безопасности и качества медицинских препаратов в России. Оно направлено на защиту интересов пациентов и общества в целом, а также на развитие фармацевтической индустрии и поддержку отечественного производителя лекарственных средств.
Новые правила оборота лекарственных средств
Росздравнадзор, государственный орган по надзору за здравоохранением, вводит новые правила, регулирующие оборот лекарственных средств в России. Эти правила предназначены для обеспечения безопасности пациентов, контроля качества лекарств и предотвращения нелегального оборота препаратов.
Одним из основных изменений является введение системы электронной регистрации лекарственных средств. Все фармацевтические компании и организации, занимающиеся производством и продажей лекарств, обязаны будут вести соответствующую электронную документацию. Это позволит точно отслеживать оборот препаратов и предотвращать подделку и контрафакт.
Кроме того, новые правила усиливают контроль за качеством лекарственных средств. Появляются дополнительные требования к производителям, включая обязательную сертификацию и проведение клинических испытаний. Также вводятся новые стандарты хранения и транспортировки лекарств, чтобы исключить возможность изменения их качества.
Одной из задач новых правил является борьба с нелегальным оборотом лекарственных средств. Оно будет строго контролироваться и незаконные сделки будут пресекаться. Это поможет улучшить доступ к качественным лекарствам и защитит пациентов от подделок и неэффективных препаратов.
Введение новых правил оборота лекарственных средств позволит повысить безопасность и качество медицинской помощи, а также улучшить контроль за оборотом лекарств и борьбу с нелегальным оборотом. Это станет важным шагом в развитии фармацевтической отрасли и обеспечит высокий уровень здравоохранения для населения страны.
Обязательная регистрация
По новым требованиям, каждый производитель или поставщик лекарственных средств обязан представить в Росздравнадзор полный пакет документов, подтверждающих качество, эффективность и безопасность препаратов. В этот пакет входит результаты клинических испытаний, фармацевтическая документация, а также сведения о производственных условиях и контроле качества.
После рассмотрения документов и проведения проверки фармацевтических предприятий, Росздравнадзор принимает решение о регистрации лекарственного средства и выдает разрешительные документы. Зарегистрированные препараты помечаются специальным знаком, который подтверждает их соответствие всем необходимым стандартам и требованиям.
| Категория лекарственного средства | Стоимость регистрации |
| Импортные лекарства | от 500 000 рублей |
| Доместические лекарства | от 300 000 рублей |
| Биологические препараты | от 1 000 000 рублей |
Введение обязательной регистрации позволит усилить контроль над лекарственными средствами, минимизировать риск подделок и контрафактных препаратов, а также повысить доверие пациентов к медицинским препаратам. Это важный шаг в обеспечении безопасности и эффективности лекарственных средств на территории России.
Контроль качества
В рамках новых правил, Росздравнадзор ужесточает контроль за качеством лекарственных средств, чтобы обеспечить безопасность и эффективность их использования.
Производители обязаны проходить сертификацию и лицензирование для предоставления доказательств соответствия своей продукции установленным требованиям. Также они должны проводить контроль качества на всех этапах производства, начиная от сырья и заканчивая готовой продукцией.
Росздравнадзор осуществляет регулярные проверки производителей, включая инспекции на производственных площадках, анализ продукции и документации. Это позволяет контролировать качество сырья, процессов производства, условий хранения и транспортировки лекарственных средств.
Также контроль качества проводится на этапе реализации — аптеки и оптовые организации должны иметь сертификаты соответствия для продажи лекарственных средств. Росздравнадзор контролирует соблюдение правил по хранению, транспортировке и отпуску медикаментов, чтобы предотвратить фальсификацию и подделку продукции.
Эффективный контроль качества позволяет обеспечить доступность безопасных и эффективных лекарственных средств для населения, а также защитить их права и здоровье.
Лицензирование производства
Лицензия на производство лекарственных средств выдается после проверки соответствия предприятия всем установленным требованиям, включая соответствие санитарным нормам, наличие квалифицированного персонала и соблюдение технологических процессов.
В процессе лицензирования проводится аудит предприятия, в ходе которого оценивается все производственное оборудование, условия хранения и транспортировки лекарственных средств. Также проверяется документация, описывающая технологические процессы, качество конечной продукции и системы контроля качества.
Преимущества обязательного лицензирования
Введение обязательного лицензирования производства лекарственных средств имеет ряд преимуществ. Во-первых, это позволит исключить с рынка некачественные и подделанные лекарственные средства, которые представляют опасность для здоровья пациентов.
Во-вторых, лицензирование позволит установить максимальный уровень безопасности производства и контролировать его соблюдение. Таким образом, фармацевтические предприятия будут обязаны придерживаться всех мировых стандартов, что способствует повышению качества лекарственных средств на российском рынке.
В-третьих, лицензирование позволит сформировать открытый и прозрачный рынок лекарственных средств. Контроль над производством и оборотом лекарственных средств позволит учитывать интересы пациентов, поддерживать здоровье населения и предотвращать возможные риски и проблемы в сфере фармации.
Маркировка препаратов
Цель маркировки — обеспечить контроль за оборотом лекарственных средств и защитить пациентов от приобретения поддельных или некачественных препаратов. Каждая упаковка должна иметь уникальный индивидуальный код, который будет отслеживаться на всем пути от производителя до конечного потребителя.
Как работает маркировка?
Процесс маркировки осуществляется с помощью специального оборудования. При производстве каждая упаковка получает уникальный штрих-код или QR-код, содержащий важную информацию о препарате, его производителе, дате выпуска и других характеристиках. Эта информация сохраняется в базе данных, доступной для проверки Росздравнадзором и другими контролирующими органами.
Преимущества маркировки
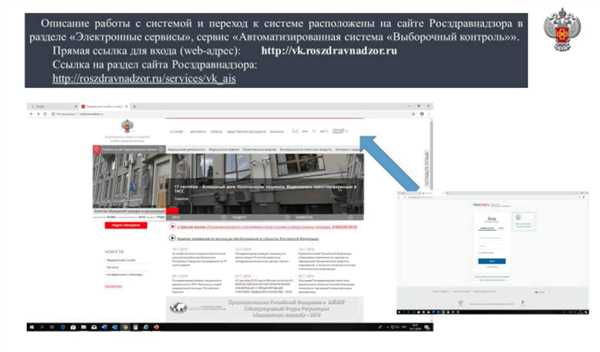
Внедрение маркировки препаратов позволит существенно повысить уровень безопасности и контроля качества лекарственных средств. Благодаря маркировке каждая доза препарата может быть однозначно отслежена, что упрощает поиск и устранение проблемных серий, контроль сроков годности и предотвращение подделок.
- Пациенты могут быть уверены в подлинности приобретаемых препаратов и их качестве.
- Производители и поставщики могут быстро обнаруживать и отзывать опасные или некачественные партии препаратов.
- Контролирующие органы имеют возможность эффективно контролировать рынок и предотвращать нарушения правил оборота лекарственных средств.
Новые правила маркировки препаратов помогут улучшить качество и безопасность лекарственных средств, что приведет к увеличению доверия пациентов и повышению эффективности работы системы здравоохранения.
Ограничения на реализацию без рецепта
Согласно новым правилам Росздравнадзора, часть лекарственных средств будет ограничена в реализации без предъявления рецепта от врача. Это меры, направленные на снижение злоупотребления определенными препаратами и повышение безопасности пациентов.
Список лекарственных средств, подлежащих ограничению, будет периодически обновляться на основе данных о их эффективности, побочных эффектах и рисках для здоровья. В первую очередь, это коснется наркотических препаратов, сильнодействующих анальгетиков, антибиотиков и некоторых психотропных лекарств.
Пациенты, нуждающиеся в приобретении этих лекарств, должны будут обратиться к врачу для получения соответствующего рецепта. Это поможет контролировать показания к использованию препаратов и исключить самолечение без медицинского совета.
Ограничение на реализацию без рецепта осуществляется в рамках международных стандартов и рекомендаций Всемирной организации здравоохранения. Аналогичные меры уже действуют во многих странах, и Россия присоединяется к этому международному опыту.
Все лекарства, подлежащие ограничению и требующие рецепта, будут помечены специальными маркировками, указывающими на необходимость консультации врача перед применением. Это позволит покупателям и фармацевтам легко определить, какие препараты требуют дополнительного внимания и ограниченного доступа.
Важно отметить, что новые правила не затрагивают лекарства, которые продолжат продаваться без ограничений и рецепта. Это в основном негормональные противозачаточные средства, витамины, детские лекарства и другие безопасные препараты, не представляющие опасности для здоровья при правильном использовании.
Процедура импорта и экспорта
Для осуществления импорта лекарственных средств на территорию России необходимо получить разрешение от Росздравнадзора. Данная процедура включает представление ряда документов, таких как заявка на разрешение импорта, копия регистрационного удостоверения лекарственного препарата в стране происхождения, аналогичное разрешение от компетентного органа другой страны и т.д.
Экспорт лекарственных средств из России также требует разрешения от Росздравнадзора. Для получения разрешения необходимо предоставить аналогичные документы, подтверждающие соответствие экспортируемых лекарственных средств техническим и качественным требованиям.
Регуляция процедуры импорта и экспорта необходима для обеспечения контроля качества лекарственных средств и исключения незаконного оборота или применения фальсифицированной продукции. Росздравнадзор стремится гарантировать безопасность и эффективность лекарственных средств, поступающих на российский рынок, а также обеспечить соответствие процессу экспорта международным требованиям и стандартам.
В случае нарушения правил импорта или экспорта лекарственных средств, Росздравнадзор имеет право применять административные меры вплоть до отмены или приостановления разрешения на торговлю данным лекарственным препаратом.
| Процедура импорта | Процедура экспорта |
|---|---|
| Получение разрешения от Росздравнадзора | Получение разрешения от Росздравнадзора |
| Представление необходимых документов | Представление необходимых документов |
| Копия регистрационного удостоверения в стране происхождения | Копия регистрационного удостоверения в стране происхождения |
| Аналогичное разрешение от компетентного органа другой страны | Аналогичное разрешение от компетентного органа другой страны |
Контрольный документооборот
Контрольный документооборот включает в себя целый ряд процедур, выполняемых предприятиями здравоохранения и фармацевтическими организациями. Вся информация о производстве, хранении и обороте лекарственных средств должна быть надежно зафиксирована и передана в соответствующие органы контроля.
Один из основных документов, участвующих в контрольном документообороте, — это таможенная декларация на ввозимые лекарственные препараты. В этом документе указывается информация о поставщике, получателе, количестве и качестве поставляемых лекарств, а также прочие обязательные детали.
Также важным документом является накладная, которая выписывается при перемещении лекарственных средств. В накладной указывается информация о поставщике, получателе, наименовании и количестве лекарств, а также подписи ответственных лиц.
Все документы, связанные с оборотом лекарственных средств, должны быть ведены в электронной форме и храниться в специальных защищенных базах данных. Это позволяет ускорить процесс обработки информации и обеспечить ее сохранность.
Организации, занимающиеся оборотом лекарственных средств, должны иметь все необходимые документы, свидетельствующие о качестве и безопасности предлагаемых медицинских препаратов. Они обязаны предоставлять информацию о всех изменениях, произошедших с препаратами, а также проводить регулярные проверки своего документооборота и информировать Росздравнадзор о выявленных нарушениях.
Контрольный документооборот является основополагающим фактором, обеспечивающим эффективный контроль и регулирование оборота лекарственных средств. Он позволяет минимизировать риски для здоровья пациентов и поддерживать высокие стандарты качества и безопасности медицинских препаратов.
Тестирование и сертификация
Тестирование лекарственных средств проводится в специализированных лабораториях с использованием современного оборудования и методов. В ходе тестирования оценивается качество, стабильность, биодоступность и другие характеристики препарата. Также проводятся клинические испытания на добровольцах, чтобы определить эффективность и побочные действия лекарственного средства.
Сертификация
После успешного прохождения тестирования лекарственное средство подлежит сертификации, которая является обязательным этапом перед его регистрацией и введением в оборот. Сертификация проводится Росздравнадзором и заключается в проверке соответствия препарата требованиям качества, безопасности и эффективности.
Роль Росздравнадзора

Росздравнадзор является государственным органом, ответственным за регулирование оборота лекарственных средств. Он осуществляет контроль за проведением тестирования и сертификации, а также надзор за производством и реализацией лекарственных препаратов. Роль Росздравнадзора заключается в обеспечении безопасности и качества лекарственных средств, а также защите здоровья населения.
Тестирование и сертификация играют важную роль в регулировании оборота лекарственных средств. Они позволяют установить соответствие препаратов требованиям качества и безопасности, а также определить их эффективность. Это важные шаги в обеспечении безопасного и эффективного лечения пациентов.
Административная ответственность
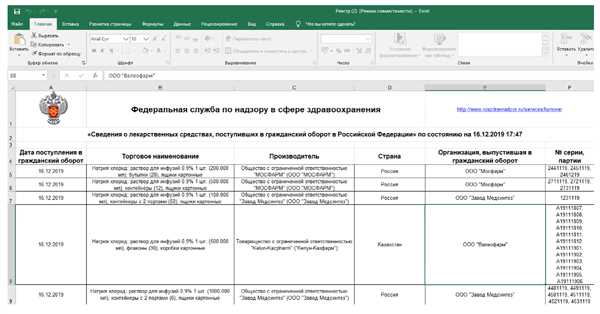
В случае нарушения регулирующих правил Росздравнадзором оборота лекарственных средств, предусмотрена административная ответственность.
К нарушителям могут быть применены следующие административные меры:
Штрафы
Нарушители обязаны уплатить штраф в размере от 10000 до 50000 рублей. В случае повторных нарушений, штраф может быть увеличен до 100000 рублей.
Санкции
Росздравнадзор имеет право принимать меры к прекращению деятельности организаций или индивидуальных предпринимателей, привлеченных к административной ответственности за нарушения в обороте лекарственных средств.
Кроме того, могут быть применены и другие меры административного характера, такие как:
- Конфискация лекарственных средств, подлежащих изъятию.
- Возможность временного или окончательного лишения лицензии на осуществление деятельности в области оборота лекарственных средств.
Административная ответственность за нарушения в области оборота лекарственных средств является мерой воздействия на нарушителей и способствует поддержанию порядка и безопасности в данной сфере деятельности.
Система накопительного опыта
В рамках новых правил, Росздравнадзор внедрил систему накопительного опыта для предприятий, занимающихся оборотом лекарственных средств. Эта система позволяет оценивать качество работы предприятий на основе накопленного опыта и выполнения требований к обороту лекарственных средств.
| Компоненты системы накопительного опыта: |
|---|
| 1. Планомерное ведение учета лекарственных средств |
| 2. Соблюдение требований к хранению препаратов |
| 3. Оценка качества и подлинности лекарственных средств |
| 4. Проведение регулярных аудитов и проверок |
С каждым выполненным требованием предприятие получает определенное количество очков, которые суммируются в системе накопительного опыта. Большое количество очков свидетельствует о высоком уровне безопасности и качества работы предприятия.
Благодаря системе накопительного опыта, Росздравнадзор имеет возможность долгосрочного мониторинга предприятий и регулярного контроля их деятельности. Это помогает обеспечить безопасность и доступность лекарственных средств для населения страны.
